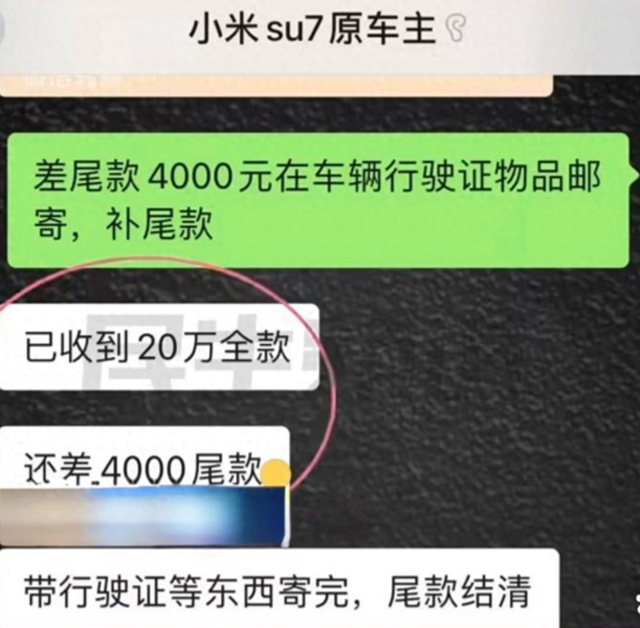
吉林省《全力抗击新冠肺炎疫情支持医药企业复工复产若干措施》:
一、促进防控药械快速上市
(一)继续开展防控产品应急审批。按照“早期介入、专人负责、即收即检、随到随审、科学审批”原则,并联检验、审评、核查,快速响应,第一时间为新冠病毒防控用第二类医疗器械、医疗机构制剂等产品实施应急审批(备案)。
(二)助力新冠病毒检测试剂注册。依托国家药监局医疗器械创新吉林服务站,建立政策咨询、业务受理、审评审批、体系检查、检验检测一体化服务平台,服务新冠病毒检测试剂等疫情防控用第三类医疗器械注册申报,积极协调开展注册检验、临床试验等上市前相关工作,加强注册申报资料的初审和技术指导,推动疫情防控用产品快速上市,并形成有效产能。
(三)支持预防治疗新冠病毒肺炎药品研发。对省内开展预防治疗新冠病毒药品研发的生产企业和科研单位,采取“一对一”方式全方位服务,选派专家提前介入,建立沟通交流、跟踪评估机制,帮助生产企业、科研单位和临床研究机构开展对接交流,并加强与国家药监局相关部门开展沟通交流,协调解决在注册申报环节中遇到的困难和问题。

二、延长行政许可期限
(四)延长注册生产许可期限。对疫情封控期间,省局审批的药品医疗器械许可证、注册证(含药品生产许可证,医疗机构配置制剂许可证;药品批发、零售连锁总部药品经营许可证,药品互联网信息服务许可证,第二类、第三类医疗器械生产许可证;第二类医疗器械注册证;医疗机构制剂注册证;)到期未能及时申请重发、换发、延续注册申报、再注册申报的,其证书有效期顺延至疫情解除后60日,企业应在疫情解除后30日内提出申请。
(五)延长登记事项变更申报期限。对疫情封控期间,省局审批的“两品一械”许可证、注册证等相关登记事项发生变化又不能及时办理变更登记的,延期至疫情解除之后30日内办理。

(六)延长化妆品许可使用期限。在疫情防控期间,化妆品生产许可因检验报告、从业人员健康证明超过规定期限等原因导致无法变更或延续的,可延期使用至疫情管控解除后60日。企业应在延期届满前补充提交有效检验报告和健康证明等材料。
三、优化审批检查方式
(七)开展网上审评审批。对因疫情影响,企业无法正常提交申报资料的,推行线上服务和“零接触”办理,通过互联网接收资料、受理业务、审评审批、核发电子版批准证明文件及许可证。待疫情结束后,企业补交纸质申请资料,领取正式批准证明文件及许可证。
(八)优化药品生产许可检查。优化检查流程,压缩检查时限,合并现场检查,采用“二合一(药品生产许可检查、GMP符合性检查或药品注册核查、GMP符合性检查)”或“三合一(药品注册核查、药品生产许可检查、GMP符合性检查)”审查方式。对于因疫情原因不能到现场开展检查的,委托辖区内检查分局(具备药品检查员资质),根据检查方案开展现场检查并出具检查报告,检查报告可为纸质版或电子版,采用电子版检查报告的,待疫情结束补交纸质版;其他环节按原流程办理。

(九)优化医疗器械现场检查。同步开展第二类医疗器械首次注册核查和生产许可现场检查,共同使用检查结果,避免重复检查。对于因疫情原因不能到现场开展检查的,可以开展网上远程检查或委托企业辖区检查分局(具备医疗器械检查员资质)开展现场检查(含医疗器械生产许可证变更),检查报告可为纸质版或电子版,采用电子版检查报告的,待疫情结束补交纸质版;其他环节按原流程办理。对于已经取得同类产品生产许可的企业,根据既往检查情况及日常监管情况,可以免予现场检查。
四、加强业务帮扶指导
(十)积极提供检验检测支撑。发挥长春空港口岸药品检验机构职能,开通预防治疗新冠病毒肺炎进口药品检验绿色通道,优化检验流程,缩短检验时限。对疫苗等生物制品批签发检验开展集中办理,加快检验进程。加强特定药品委托检验的先期沟通,即来即检。
(十一)支持药品流通企业创新发展。继续推动《关于促进药品流通企业创新发展的意见》落地落实,通过鼓励药品流通企业兼并重组、促进仓储资源整合、支持药品经营企业与互联网企业加强合作、优化审批服务等多种举措,降低药品流通成本,助力药品流通企业抗击疫情、创新发展。
(十二)强化复工复产服务保障。加强对医药企业复工复产情况调度监测,动态掌握企业复工复产进程和生产组织情况,协调解决企业在复工复产过程中存在的困难和问题。督促企业全面从严落实疫情防控和产品质量安全主体责任,提升安全风险管控能力。围绕产品检验、质量管理、标准执行等方面,指导企业加强业务培训,完善产品质量管控体系,提升管理水平,增强市场竞争力。